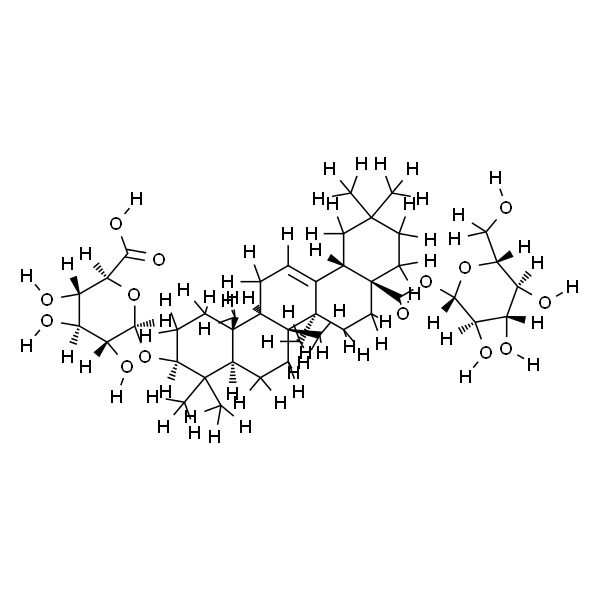
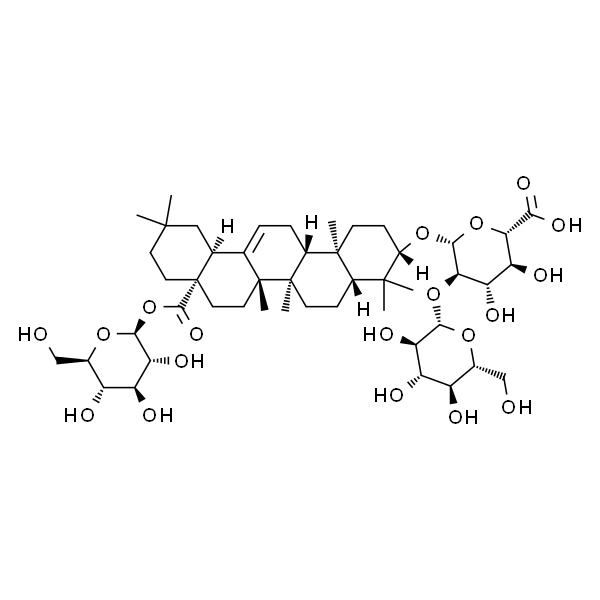
人参皂苷Ro
| MDL | MFCD01732056 |
| 别名 | Chikusetsusaponin 5; Chikusetsusaponin V; Polysciasaponin P3; 竹节参苷V |
| 英文名称 | Ginsenoside Ro |
| CAS | 34367-04-9 |
| 分子式 | C48H76O19 |
| 分子量 | 957.11 |
| 纯度 | HPLC≥98% |
| 单位 | 瓶 |
| 生物活性 | Ginsenoside Ro 具有 Ca2+ 拮抗剂的抗血小板作用,IC50 为 155? μM。Ginsenoside Ro 降低 TXA2 产量,Ginsenoside Ro 还稍弱地降低 COX-1 和 TXAS 活性。[1-4] |
| In Vitro | 人参中的人参皂甙Ro是一种有益的新型Ca2 + – 拮抗剂化合物,可预防血小板聚集介导的血栓性疾病。人参皂甙Ro剂量依赖性地降低凝血酶刺激的血小板聚集,IC50约为155μM[1]。人参皂甙Ro抑制TXA2产生以消除凝血酶诱导的血小板聚集。血栓素A2(TXA2)诱导血小板聚集并促进血栓形成。人参皂甙Ro剂量依赖性(50-300μM)降低凝血酶诱导的TXB2水平;人参皂甙Ro(300μM)抑制凝血酶介导的TXB2水平升高94.9%。不存在人参皂甙Ro(阴性对照)时的COX-1活性为2.3±0.1nmol/mg蛋白质。然而,人参皂甙Ro剂量依赖性(50-300μM)降低其活性;在300μM时,COX-1活性降低阴性对照的26.4%。在不存在人参皂甙Ro(阴性对照)的情况下TXA2合酶(TXAS)活性为220.8±1.8ng/mg蛋白质/分钟。然而,人参皂甙Ro剂量依赖性(50-300μM)降低其活性;在300μM时,TXAS活性降低阴性对照的22.9%。人参皂甙Ro(300μM)对TXB2产生的抑制作用(94.9%)显著高于COX-1(26.4%)和TXAS(22.9%)活性[2]。为了评估人参皂甙Ro在Raw 264.7细胞中的毒性,首先用各种浓度(10μM,50μM,100μM和200μM)的人参皂苷Ro处理它们24小时。人参皂苷Ro没有显示出显著的剂量依赖性毒性。接下来,在用1μg/ mL LPS处理后,人参皂苷Ro对细胞活力和ROS水平(氧化应激的标志物)的影响确定。与未处理的对照相比,LPS使细胞活力降低~70%。在1μg/ mL LPS孵育24小时之前用100μM和200μM人参皂苷Ro预处理1小时导致细胞活力的显著增加。 ROS水平和NO产生的变化与人参皂甙Ro对活力的影响一致[3]。 |
| In Vivo | 溶解于水中的人参皂甙Ro以25和250mg / kg /天的剂量通过管饲法给予小鼠4天,然后静脉注射HT29,以便在注射HT29之前将人参皂甙Ro的血液浓度保持在一定水平以上,然后40口服给予小鼠人参皂甙Ro的天数。处理38天后,对动物实施安乐死,除了评估人参皂甙Ro的毒性和HT29的小鼠病理学外,还计数肺转移性结节的数目。人参皂甙Ro(250 mg / kg /天)使肺表面肿瘤结节数显着减少,抑制率达到88%(P <0.01)[4]。 |
| 激酶实验 | 将血小板的微粒体部分与奥扎格雷(11nM,IC50),阳性对照或使用各种浓度的人参皂苷Ro和其他试剂在37℃预温育5分钟。通过加入前列腺素H2引发反应,并将样品在37℃下孵育1分钟;通过加入柠檬酸(1M)终止反应。用1N NaOH中和后,使用TXB2 EIA试剂盒[2]测定TXB2的量。 |
| SMILES | O=C([C@]1(CCC(C)(C)C2)[C@]2([H])C3=CC[C@@]4([H])[C@@](C)(CC[C@]5([H])[C@@]4(CC[C@H](O[C@@](O[C@H](C(O)=O)[C@@H](O)[C@@H]6O)([H])[C@@H]6O[C@]([C@@H]([C@@H](O)[C@@H]7O)O)([H])O[C@@H]7CO)C5(C)C)C)[C@]3(C)CC1)O[C@@H]([C@@H]([C@@H](O)[C@@H]8O)O)O[C@@H]8CO |
| 靶点 | Others |
| 动物实验 | 小鼠[4]使用雌性BALB/c小鼠(20-25g,6-8周龄)。通过尾静脉注射HT29细胞建立肺转移的实验模型,以模拟CTC的传播。将在0.2mL PBS中2×106个细胞数的HT29细胞感染到6周龄雌性Balb/c小鼠的尾静脉中。在HT29接种之前,每天给予PBS悬浮的B(人参皂甙Ro)的口服管饲预处理4天,然后进行40天的处理。治疗组(N = 10)包括:0mg/kg,25mg/kg和250mg/kg人参皂苷Ro。每四天测量并记录体重。在肿瘤转移和生长40天后处死小鼠,用B处理44天处死小鼠。在每个处理组中评估表面肺转移结节的数量。制备具有4-5μm厚的肺切片的载玻片,石蜡包埋,然后用苏木精和曙红染色[4]。 |
| 细胞实验 | 用MTT测定试剂盒测定细胞活力。简而言之,将Raw 264.7细胞以每孔2.0×10 4个细胞的密度接种在48孔板中,孵育24小时,并用各种浓度的人参皂苷Ro处理24小时。然后用1μg/ mL LPS处理用人参皂甙Ro(50μM,100μM和200μM)预处理1小时如何影响Raw 264.7细胞的存活率24小时。孵育期后,向每个孔中加入10μLMTT试剂,并在37℃,5%CO 2中孵育3小时。随后将所得的甲crystals晶体溶解在MTT增溶溶液中。使用酶标仪在540nm处测定吸光度[3]。 |
| 数据来源文献 | [1]. Kwon HW, et al. Inhibitory Effects of Cytosolic Ca2+ Concentration by Ginsenoside Ro Are Dependent on Phosphorylation of IP3RI and Dephosphorylation of ERK in Human Platelets. Evid Based Complement Alternat Med. 2015;2015:764906.
[2]. Jung-HaeShin, et al. Inhibitory effects of thromboxane A2 generation by ginsenoside Ro due to attenuation of cytosolic phospholipase A2 phosphorylation and arachidonic acid release. J Ginseng Res. 9 Jan 2018. [3]. Kim S, et al. Upregulation of heme oxygenase-1 by ginsenoside Ro attenuates lipopolysaccharide-induced inflammation in macrophage cells. J Ginseng Res. 2015 Oct;39(4):365-70. [4]. Jiang Z, et al. The traditional Chinese medicine Achyranthes bidentata and our de novo conception of its metastatic chemoprevention: from phytochemistry to pharmacology. Sci Rep. 2017 Jun 20;7(1):3888. |
| 规格 | 5mg 10mg 10mM*1mL (in DMSO) |
通过ESR2-NCF1-ROS途径抑制自噬-溶酶体融合。