Tau蛋白聚集和阿尔茨海默氏症
什么是Tau蛋白?
Tau是神经元中稳定微管的一类蛋白。Tau蛋白主要存在于轴突当中, 但是也可以在树突和其他神经元部分出现。在一些神经衰退疾病中,例如tau蛋白病,tau蛋白从微管上脱落下来,在脑中形成了不溶性聚集物。
Tau和阿尔茨海默氏症
阿尔茨海默氏症 (AD) 是目前最常见的神经衰退疾病之一, 威胁着 10% 的 65岁以上的老人1。这个疾病是根据一位德国科学家Alois Alzheimer命名的, 他在1907 年于一个过世的痴呆症患者的脑中发现了出现于神经元中的缠结的纤维2。AD 的一个患病特征就是含有淀粉样肽beta的斑块和含有tau的神经纤维缠结(NFTs)。
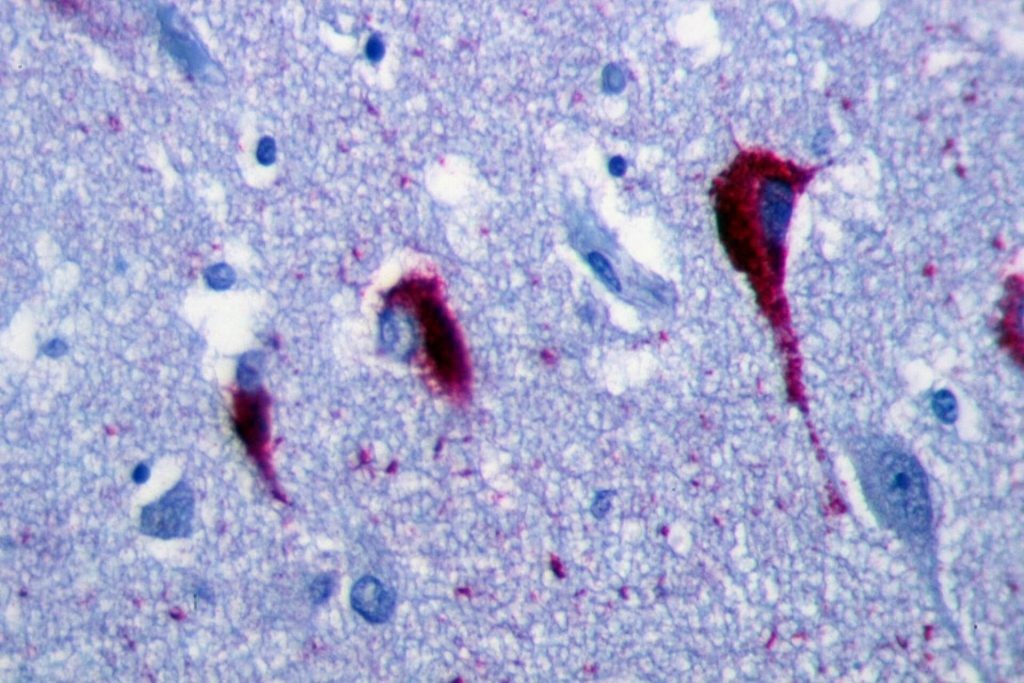
阿尔茨海默氏症患者的海马体免疫组化显示神经纤维缠结. Patho [CC BY-SA 3.0], 图片来自 Wikimedia Commons
Tau蛋白结构
Tau蛋白易溶解于水溶液中3,没有稳定的二级或三级结构4。Tau蛋白分子结构含有四个区域: 氨基末端,富脯氨酸区域,重复区域,以及羧基末端区域5。Tau蛋白作为一个整体是亲水的.6 在细胞质中游离的tau形状像是“曲别针” , 这个结构使 N 末端和 C 末端都位于重复序列的附近.7
Tau蛋白异构体
表达Tau 蛋白的基因是 MAPT , 位于人17号染色体上。由于tau基因的选择性剪接,成人大脑中有六种异构体。有三种异构体是有三段微管结合重复区域 (3R),另三种是有四段微管结合重复区域 (4R)8。异构体的大概有352-441个氨基酸,分子量为60-74 kDa.5。在人胎儿大脑中只有最短的异构体被表达9。
Tau蛋白病
在神经衰退疾病中,tau蛋白聚集形成神经纤维缠结 (NFTs) 的一类被称为tau蛋白病,包括 AD, 皮质基底节变性, 额颞叶痴呆, 额颞叶变性, 进行性核上性麻痹, 以及PD10。有研究表明在亨廷顿舞蹈症病人中也可见到tau蛋白的聚集增加,包括棒状沉淀11。
Tau蛋白聚集
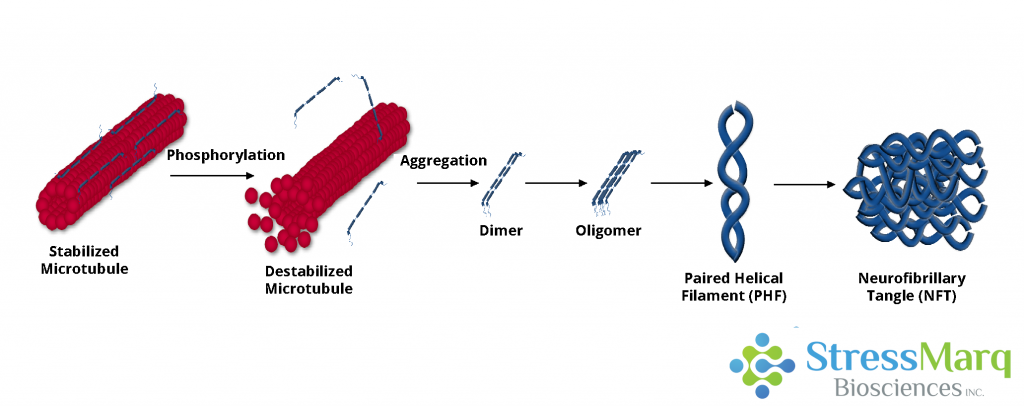
图表显示了tau蛋白从微管上脱离,导致了微管的解体。脱落下来的tau蛋白聚集形成寡聚体,成对螺旋丝,最后形成了神经纤维缠结。
翻译后修饰
Tau的翻译后修饰 (PTMs) 非常多,包括磷酸化、糖基化、硝化、O-GlcNAc糖基化、乙酰化、氧化、泛素化、SUMO化以及甲基化12。这些 PTM 调控着tau蛋白对微管蛋白的亲和力13。高度泛素化的tau蛋白就被发现于 AD 和其他tau蛋白病当中,12 赖氨酸和其他一些PTM 损害tau的功能并促进了单体的聚集10。在tau蛋白病转基因的小鼠大脑中可检测到K280的乙酰化,但是在对照组小鼠中检测不到14,这个结果暗示了tau蛋白的乙酰化修饰可能与tau蛋白病相关。虽然tau蛋白有非常多的翻译后修饰,但是目前被研究最多的还是磷酸化。
Tau 蛋白的过度磷酸化
Tau蛋白的20%的氨基酸都可以是潜在的磷酸化位点8。通常情况下,tau蛋白的微管结合区域是带正电的,因此可以吸引带负电的微管。当这个微管结合区域高度磷酸化以后,它就失去了正电量,从微管蛋白上脱离下来,不再具有结合稳定微管的能力了。接下来造成微管蛋白的失效,而且高度磷酸化的tau聚集沉淀,对神经细胞有毒性,这些后果共同造成了神经衰退病因15。
成对螺旋丝
两个高度磷酸化的tau蛋白单体因为结构的改变,可以结合形成二聚体8。这个二聚体化由重复区2 和 3 的六元胜肽相互作用开始,接下来导致tau蛋白的寡聚化反应16。寡聚体进一步形成具有双螺旋纽带结构的成对螺旋丝 (PHFs)17。在 PHFs 中的 tau 蛋白比tau蛋白单体带更多的负电量,因此无法与带负电的微管蛋白结合或有效地稳定微管 18。没有了tau蛋白的稳定,微管结构网就很容易解体,导致神经元无法再正常工作。
神经元纤维缠结
NFTs 是丝状的、不可溶的tau聚集体, 含有增多的 β 折叠结构19,含有聚集的 PHFs. NFT在大脑中的的沉积程度与痴呆的严重程度20和神经元死亡有关21。AD患者中其他形式的tau聚集体包括神经纤维网线 (neuropil threads) 和神经斑块,也会引起神经元的衰退22,然而有些研究表明丝状和纤维状的tau可能对神经元有保护作用,高度磷酸化的tau寡聚体是最具毒性的一种23。
Tau 蛋白的聚集增殖
关于Tau蛋白疾病中tau的聚集增殖机制,有一种假设提出是 “似朊蛋白自我复制繁殖” 。这个机制是tau“种子”或纤维从一个供体细胞转移到一个受体细胞,然后聚集更多内源tau蛋白形成PFFs24。虽然tau蛋白和朊蛋白的增殖方式类似,但是目前不清楚tau是不是和朊蛋白还有其他类似的特征,比如人和人之间传染的可能性25。
Tau 前体纤维原
前体纤维原 (PFFs) 可以诱导人工培养的细胞25和动物活体13中的tau蛋白的聚集,使可溶的单体聚集形成不溶纤维。在表达tau蛋白的细胞中引入少量的tau PFFs就可以引起大量的tau聚集形成丝状包含物类似NFTs27。合成的tau PFFs也可以进入到非神经细胞中聚集tau蛋白形成 NFTs28。
Tau PFFs 可以充当种子,聚集单体形成更大的纤维体。
Tau 截短蛋白
有些研究显示在原代神经元中,全长 tau PFFs 的种子聚集作用比截短的K18蛋白要强28。然而,当截短蛋白和全长 tau蛋白同时在小鼠中表达时,会引起严重的但是可逆的神经毒性29。这可能是由于可溶的、非丝状、高分子量的寡聚体对神经元有毒性29。
Tau 和α-突触核蛋白
超过 50% 的AD 疾病涉及到路易体的形成、β-淀粉样斑块,而PD病人和路易体痴呆病人的脑中经常可见NFTs30。α-突触核蛋白和tau 可以在体外促进单体的纤维化31,tau纤维和α-突触核蛋白在路易体中显示出共同的定位32。α-突触核蛋白PFFs 促进tau蛋白的磷酸化,在体外诱发tau蛋白的聚集33。Tau蛋白和 α-突触核蛋白的相互作用和纤维化可能出现在tau蛋白病和突触核蛋白病中。
未来治疗方式
AD以及其他tau蛋白疾病的几种治疗研究方案都涉及到以tau蛋白为靶点。Tau 的高度磷酸化由蛋白激酶和磷酸酶调控34,针对tau蛋白高度磷酸化的治疗需要抑制tau激酶,修复蛋白磷酸酶 2A, 或者以tau蛋白的O-糖基化为目标靶点35。另外,针对神经炎症的治疗也是一个研究方向,因为神经炎症对tau的增殖也有促进作用15。用tau蛋白抗体免疫小鼠也显示出对疾病恶化有缓和作用36,这表示免疫治疗可能也是一种潜在的治疗方案。
Tau蛋白相关产品
活性 Tau 纤维原
活性 Tau441 (2N4R), P301S 蛋白单体
活性 Tau (K18), P301L 蛋白单体
活性 Tau441 (2N4R), P301S 蛋白前体纤维原PFFs
活性 Tau (K18), P301L 蛋白前体纤维原PFFs
抗-Tau 抗体 (pSer396)
抗-Tau 抗体 (pSer422)
更多详情请咨询Stressmarq优势代理商-上海金畔生物
