什么是表观遗传学?
你的基因对你的健康起着重要作用,但你的行为和环境也起着重要作用,比如你吃什么,你的身体活动程度如何。表观遗传学是研究你的行为和环境如何导致影响基因工作方式的变化的学科。与遗传变化不同,表观遗传变化是可逆的,不会改变你的DNA序列,但它们可以改变你的身体读取DNA序列的方式。
基因表达是指根据基因中的指令产生蛋白质的频率或时间。虽然基因变化可以改变蛋白质的组成,但表观遗传变化会影响基因表达,从而“打开”和“关闭”基因。由于饮食和运动等环境和行为会导致表观遗传变化,因此很容易看出基因与行为和环境之间的联系。
表观遗传学是如何工作的?
表观遗传变化以不同方式影响基因表达。表观遗传变化的类型包括:
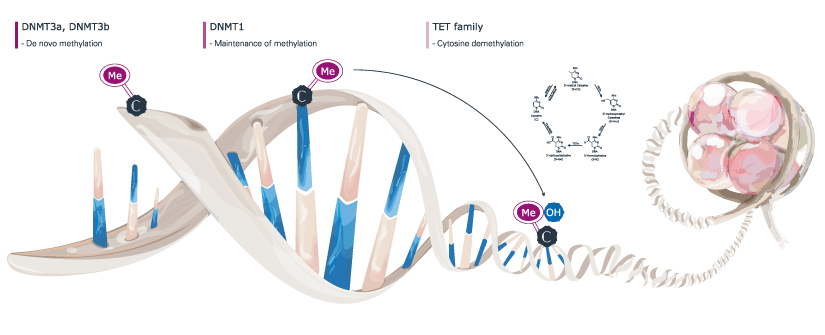
DNA甲基化
DNA甲基化通过向DNA中添加一个化学基团来起作用。通常,这一组被添加到DNA上的特定位置,在那里它阻止附着在DNA上的蛋白质“读取”基因。这种化学基团可以通过称为去甲基化的过程去除。通常,甲基化使基因“关闭”,去甲基化使基因“开启”
组蛋白修饰
DNA包裹着称为组蛋白的蛋白质。紧密包裹在组蛋白周围的DNA不能被“读取”基因的蛋白质访问。一些基因包裹在组蛋白周围并“关闭”,而一些基因没有包裹在组蛋白周围并“打开”。可以从组蛋白中添加或删除化学基团,并改变基因是否被打开或包裹(“打开”或“关闭”)。
非编码RNA
你的DNA被用作制造编码和非编码RNA的指令。编码RNA用于制造蛋白质。非编码RNA通过与编码RNA和某些蛋白质结合,分解编码RNA,使其不能用于制造蛋白质,从而帮助控制基因表达。非编码RNA也可能招募蛋白质来修饰组蛋白,从而“打开”或“关闭”基因。
你的表观遗传学如何改变?
你的表观遗传学随着年龄的增长而变化,这既是正常发育和衰老的一部分,也是对你的行为和环境的反应。
表观遗传学与发育
表观遗传变化在你出生之前就开始了。你所有的细胞都有相同的基因,但外观和行为却不同。随着你的生长发育,表观遗传学有助于确定一个细胞将具有哪些功能,例如,它将成为心脏细胞、神经细胞还是皮肤细胞。
示例:神经细胞与肌肉细胞
你的肌肉细胞和神经细胞有相同的DNA,但工作方式不同。神经细胞将信息传输到身体的其他细胞。肌肉细胞的结构有助于提高身体的运动能力。表观遗传学允许肌肉细胞“打开”基因,使蛋白质对其工作重要,并“关闭”对神经细胞工作重要的基因。
表观遗传学与年龄
你的表观遗传学在你的一生中都会发生变化。出生时的表观遗传学与童年或成年时的表观遗传学不同。
例:新生儿与26岁与103岁的对比研究
对一名新生儿、26岁和103岁的婴儿进行了数百万个位点的DNA甲基化检测。DNA甲基化水平随着年龄的增长而降低。新生儿的DNA甲基化水平最高,103岁的DNA甲基化水平最低,26岁的DNA甲基化水平介于新生儿和103岁之间(1)。
表观遗传学与可逆性
并非所有的表观遗传变化都是永久性的。一些表观遗传变化可以根据行为或环境的变化而添加或删除。
例:吸烟者与非吸烟者与前吸烟者
吸烟会导致表观遗传变化。例如,在AHRR基因的某些部分,吸烟者的DNA甲基化程度往往低于不吸烟者。重度吸烟者和长期吸烟者之间的差异更大。戒烟后,前吸烟者可能开始增加该基因的DNA甲基化。最终,他们可以达到与不吸烟者相似的水平。在某些情况下,这种情况可能在一年内发生,但时间长短取决于戒烟前吸烟的时间和数量。
表观遗传学与健康
表观遗传变化会以不同方式影响您的健康:
传染
细菌可以改变你的表观遗传学,削弱你的免疫系统。这有助于细菌存活。
例:结核分枝杆菌
结核分枝杆菌引起肺结核。感染这些细菌会导致某些免疫细胞中的组蛋白发生变化,从而导致“关闭”IL-12B基因。关闭IL-12B基因会削弱你的免疫系统,提高结核分枝杆菌的存活率(3)。
巨蟹座
某些突变使你更容易患癌症。类似地,某些表观遗传变化会增加患癌症的风险。例如,BRCA1基因突变使其无法正常工作,这使你更有可能患乳腺癌和其他癌症。类似地,导致BRCA1基因表达降低的DNA甲基化增加了患乳腺癌和其他癌症的风险(4)。虽然癌细胞增加了某些基因的DNA甲基化,但与正常细胞相比,癌细胞的总体DNA甲基化水平较低。看起来相似的不同类型的癌症可能有不同的DNA甲基化模式。表观遗传学可用于帮助确定一个人患有哪种类型的癌症,或有助于尽早发现难以发现的癌症。单靠表观遗传学无法诊断癌症,癌症需要通过进一步的筛查测试来确认。
例:结直肠癌
结直肠癌增加了SEPT9基因的甲基化。一些商业的基于表观遗传学的结直肠癌检测着眼于SEPT9基因的DNA甲基化水平。当与其他诊断筛查测试一起使用时,这些基于表观遗传学的测试可以帮助早期发现癌症(5)(6)。
孕期营养
孕妇怀孕期间的环境和行为,如是否食用健康食品,会改变婴儿的表观遗传学。其中一些变化可能会持续几十年,并可能使儿童更容易患某些疾病。
例如:荷兰饥饿冬季饥荒(1944-1945)
母亲在饥荒期间怀孕的人更容易患上某些疾病,如心脏病、精神分裂症和2型糖尿病(7)。饥荒发生大约60年后,研究人员观察了母亲在饥荒期间怀孕的人的甲基化水平。与出生前没有遭受饥荒的兄弟姐妹相比,这些人在某些基因上的甲基化增加,而在其他基因上的甲基化减少(8)(9)(10)。甲基化的这些差异有助于解释为什么这些人在晚年患某些疾病的可能性增加(7)(10)(11)(12)。
相关文献:
1.Heyn H, Li N, Ferreira H, et al., Distinct DNA methylomes of newborns and centenariansexternal icon. Proc Natl Acad Sci U S A 2012; 109:10522-7
2.McCartney D, Stevenson A, Hillary R, et al., Epigenetic signatures of starting and stopping smokingexternal icon. EBioMedicine 2018; 37:214-220
3.Chandran A, Antony C, Jose L, et al., Mycobacterium Tuberculosis Infection Induces HDAC1-Medicated Suppression of IL-12B Gene Expression in Macrophagesexternal icon. Front Cell Infect Microbiol 2015; 5:90.
4.Tang Q, Cheng J, Cao X, et al., Blood-based DNA methylation as biomarker for breast cancer: a systematic reviewexternal icon. Clin Epigenetics 2016; 8: 115.
5.Johnson D, Barclay R, Mergener K, et al., Plasma Septin9 Versus Fecal Immunochemical Testing for Colorectal Cancer Screening: A Prospective Multicenter Studyexternal icon. PLoS One 2014; 9:e98238.
6.Food and Drug Administration. Epi proColonpdf iconexternal icon. 2016 [accessed 29 June 2020].
7.Roseboom T., Epidemiological evidence for the developmental origins of health and disease: effects of prenatal undernutrition in humansexternal icon. J Endocrinol 2019. 242:T135-T144
8.Heijmans B, Tobi E, Stein A, et al., Persistent epigenetic differences associated with prenatal exposure to famine in humansexternal icon. Proc Natl Acad Sci U S A 2008; 105: 17046-17049.
9.Tobi E, Lumey L, Talens R, et al., DNA Methylation Differences After Exposure to Prenatal Famine Are Common and Timing- And Sex- Specificexternal icon. Hum Mol Genet 2009; 18:4046-53.
10.Tobi E, Slieker R, Luijk R, et al., DNA methylation as a mediator of the association between prenatal adversity and risk factors for metabolic disease in adulthoodexternal icon. Sci Adv 2018; 4:eaao4364.
11.Dayeh T, Tuomi T, Almgren P, et al., DNA Methylation of Loci Within ABCG1 and PHOSPHO1 in Blood DNA is Associated With Future Type 2 Diabetes Riskexternal icon. Epigenetics 2016; 7: 482-8.
12.Pidsley R, Dempster E, Troakes C, et al., Epigenetic and genetic variation at the IGF2/H19 imprinting control region on 11p15.5 is associated with cerebellum weightexternal icon. Epigenetics 2012; 7:155-163.