β淀粉样肽在阿尔兹海默症中的作用
阿尔茨海默病(AD)的特征是记忆和执行功能的进行性丧失,这可归因于大脑各区域内的突触损伤和神经退行性变。它是全世界痴呆症最常见的病因,预计随着人口老龄化,AD发病率将上升。几十年来,β淀粉样肽(Aβ)蛋白一直是阿尔茨海默病研究的焦点,这主要是因为AD患者的大脑中老化斑块的主要成分是 Aβ。然而,虽然老化斑块曾被认为是阿尔茨海默病病理学的原因,但事实可能并非如此1,2。相反,越来越多的证据表明aβ寡聚体是aβ的主要毒性物种,突出了其治疗靶向性的潜力。
淀粉样蛋白级联假说已经失宠
在正常情况下,长度为37到49个残基的Aβ肽被β-和γ-分泌酶从淀粉样前体蛋白(APP)中依次切割,然后从细胞中释放并迅速降解。这一过程的失调导致Aβ肽积累并形成淀粉样纤维,从而导致老化斑块。Aβ40和Aβ42是斑块的主要成分,其中Aβ42是两种异构体中神经毒性更强的3。1992年,有人提出老化斑块与神经原纤维缠结的形成和随后的神经元细胞死亡有关,这种现象被称为淀粉样蛋白级联假说1。但是,多年来,一些重要的观察结果使研究人员对这一理论产生了怀疑。其中包括:阿尔茨海默病的发病与斑块负荷之间的相关性较差;神经元细胞死亡发生在没有斑块的大脑区域;Aβ斑块存在于认知正常的个体中。此外,一些出现阿尔茨海默病症状的患者大脑中缺乏病理变化,这表明较大的聚集物不是神经退行性变的原因4。
揭示aβ寡聚体在AD发病机制中的作用
现在,淀粉样蛋白级联假说已被寡聚体级联假说所取代,该假说提出寡聚体而非老化斑块是阿尔茨海默病的起始病理因素2。寡聚体是直径约为3至10 nm的小球形结构,由多个非共价组装成簇的Aβ肽组成4,5。在AD的早期阶段,当它们定位于神经元突触或其内部时,它们明显增加,并通过许多实验方法显示其毒性作用6。例如,体外产生的Aβ寡聚体已被证明对原代小鼠皮层神经元有毒,而直接从阿尔茨海默病大脑中提取的寡聚体已被证明会损害突触结构和功能7,8。最近,在iPSC衍生的人类神经元中进行的研究表明,几种蛋白质在对寡聚体挑战的反应中受到差异调节,而利用人类AD和小鼠脑组织进行的研究已确定寡聚体附着的突触蛋白质,促使人们努力确定如何将其作为治疗靶点6,9。
支持阿尔茨海默病研究
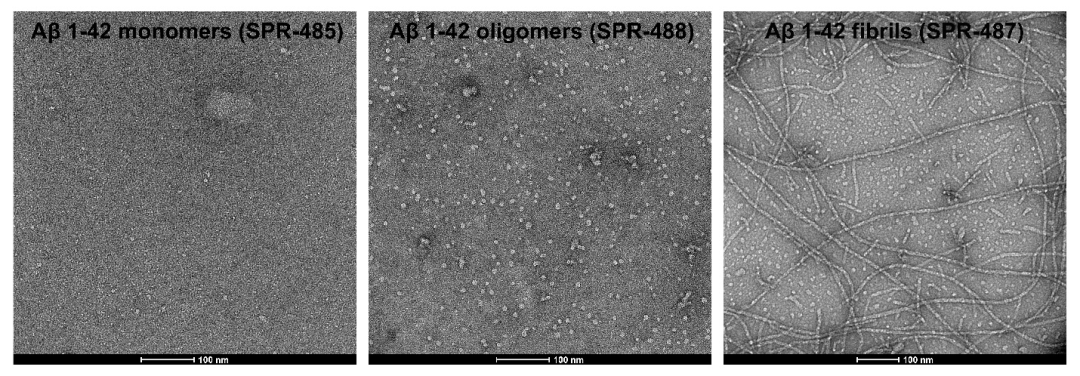
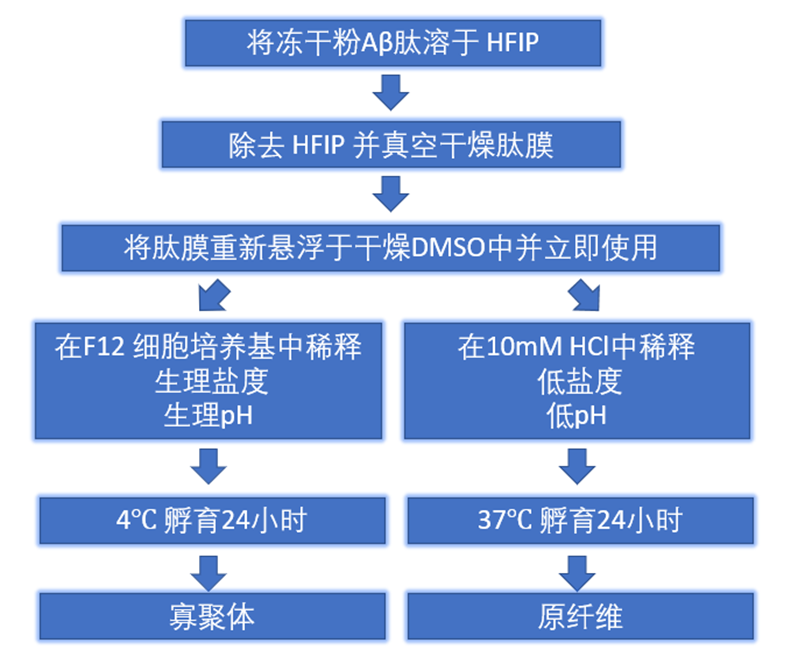
StressMarq提供了广泛的产品选择以支持阿尔茨海默病研究,包括Aβ单体(目录#SPR-485)、寡聚体(目录#SPR-488)和预成型原纤维(目录#SPR-487)。我们的Aβ寡聚体是由Aβ肽1-42生成的,使用已公布的方法用1,1,1,3,3,3-六氟-2-丙醇(HFIP)预处理。当在透射电子显微镜(TEM)和原子力显微镜(AFM)下观察时,它们表现出球状构象,并且在带有抗淀粉样β抗体的Western Blot上具有独特的二聚体/三聚体和寡聚体信号。重要的是,我们获得的数据显示,我们的Aβ寡聚体对原代大鼠皮层神经元具有剂量依赖性毒性。
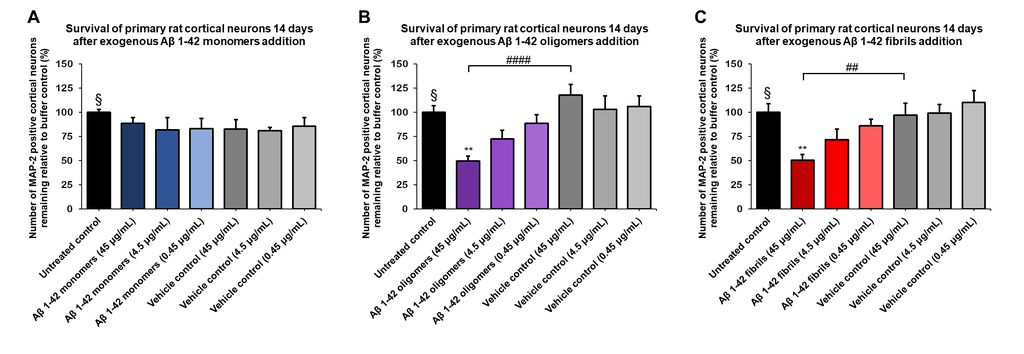
Aβ 1-42 寡聚体 (SPR-488) 和原纤维 (SPR-487) 对原代大鼠皮层神经元显示出剂量依赖性毒性,但单体 (SPR-485) 没有毒性。大鼠原代皮层神经元用不同浓度的 (A) 单体、(B) 寡聚体或 (C) 原纤维处理 14 天后的存活率,由 MAP2 阳性神经元量化并表示为对照的百分比(空白对照设为100%)。原纤维和相应的载体对照先在 Bioruptor 超声破碎仪中进行超声处理。测试条件在与未处理的对照和载体对照相同的板中运行,由不含Aβ 1-42 蛋白的缓冲液组成。数据表示为平均值 +/- s.e.m. (n = 6)。使用单向方差分析和 Dunnett 检验对数据进行全局分析; ** p<0.01 统计数据相比于对照; ## p<0.01, #### p<0.0001 统计数据相比于载体对照。 § 代表未经处理的对照条件。
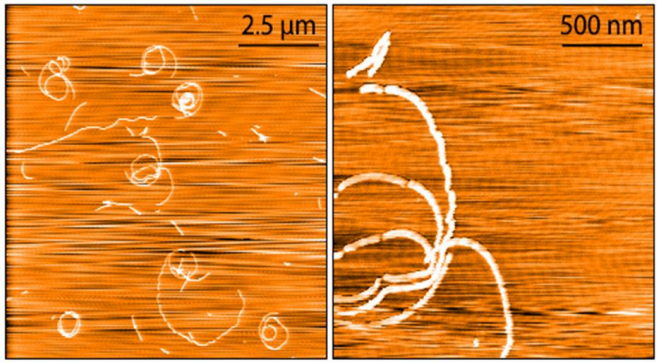
从左至右分别为Aβ单体 (SPR-485),寡聚体 (SPR-488) 和原纤维 (SPR-487) 的电镜图。负染色透射电子显微镜图像在 80 Kv 下在碳涂层的 400 目铜网格上使用磷钨酸和乙酸双氧铀染色获得。比例尺 = 100 nm。
StressMarq 同时还提供 淀粉样蛋白寡聚物(A11) 抗体 (目录# SPC-506) 和 淀粉样蛋白纤维 (OC) 抗体 (目录# SPC-507). 两个抗体都有验证应用 Western Blot, IHC, ICC/IF 和IP.
参考文献
1. Alzheimer’s disease: the amyloid cascade hypothesis, Hardy JA and Higgins GA, Science. 1992;256(5054):184-185
2. Amyloid β-protein oligomers and Alzheimer’s disease, Haydon EY and Teplow DB, Alzheimers Res Ther. 2013;5(6):60
3. Reconsideration of Amyloid Hypothesis and Tau Hypothesis in Alzheimer’s Disease, Kametani F and Hasegawa M, Front Neurosci. 2018;12:25
4. The Role of Amyloid-β Oligomers in Toxicity, Propagation, and Immunotherapy, Sengupta U et al, EBioMedicine. 2016 Apr; 6: 42–49
5. Kinetic diversity of amyloid oligomers, Dear AJ et al, Proc Natl Acad Sci U S A. 2020;117(22):12087-12094
6. Amyloid Beta Oligomers Target to Extracellular and Intracellular Neuronal Synaptic Proteins in Alzheimer’s Disease, Ding Y et al, Front Neurol. 2019;10:1140
7. Structural conversion of neurotoxic amyloid-beta(1-42) oligomers to fibrils, Ahmed M et al, Nat Struct Mol Biol. 2010;17(5):561-567. doi:10.1038/nsmb.1799
8. Amyloid-beta protein dimers isolated directly from Alzheimer’s brains impair synaptic plasticity and memory, Shankar GM et al, Nat Med. 2008;14(8):837-842.
9. Oligomeric amyloid-β induces early and widespread changes to the proteome in human iPSC-derived neurons, Sackmann C and Hallbeck M, Sci Rep. 2020;10(1):6538
更多详情请咨询Stressmarp代理商 – 上海金畔生物