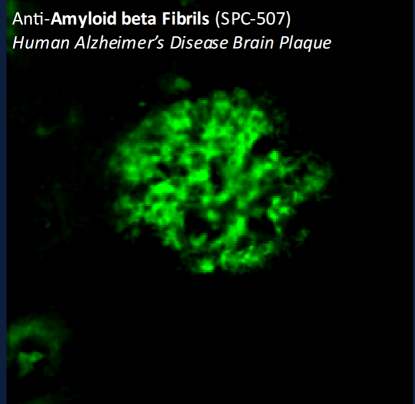
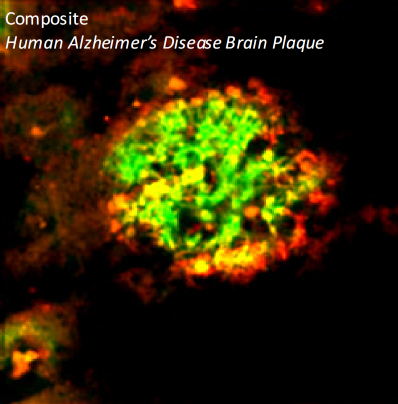
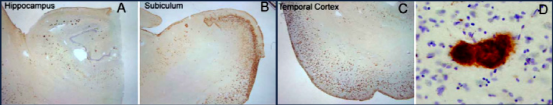
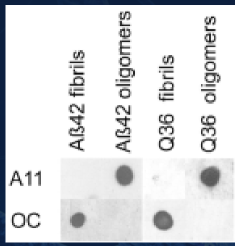
Β淀粉样蛋白-β淀粉样蛋白 1-42 寡聚体
Stressmarq公司研发的β淀粉样蛋白,该产品有3种规格,产品货号为SPR-488,如需购买Stressmarq公司产品,请联系国内代理商-上海金畔生物,本文是对该产品的详细介绍。
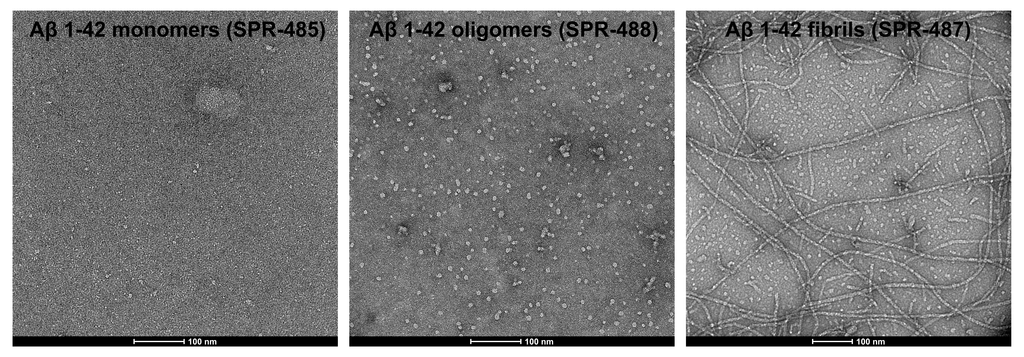 |
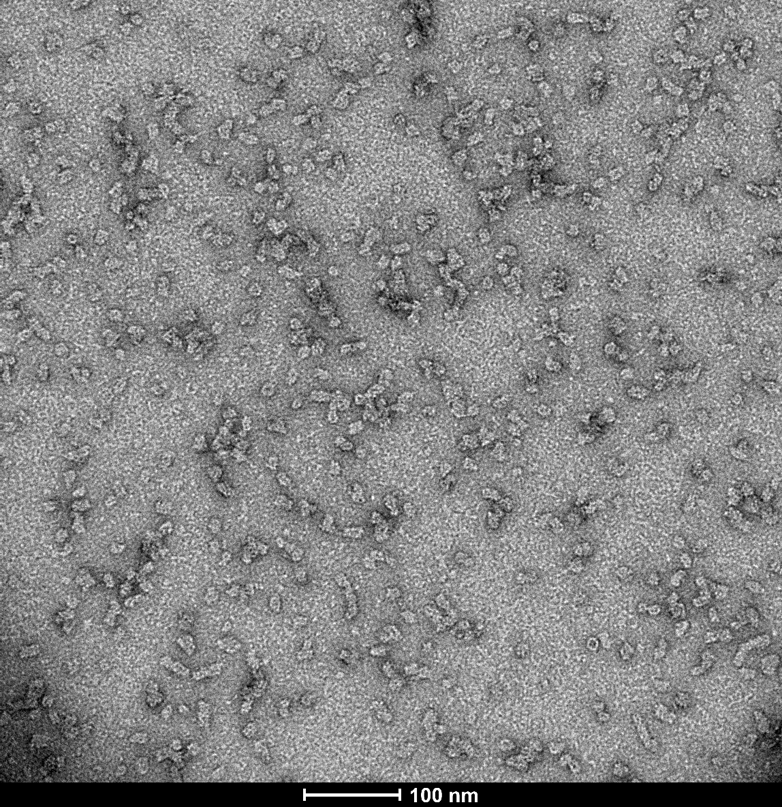
从左至右分别为Aβ单体 (SPR-485),寡聚体 (SPR-488) 和原纤维 (SPR-487) 的电镜图。负染色透射电子显微镜图像在 80 Kv 下在碳涂层的 400 目铜网格上使用磷钨酸和乙酸双氧铀染色获得。比例尺 = 100 nm。 |
 |
从左至右分别为Aβ单体 (SPR-485),寡聚体 (SPR-488) 和原纤维 (SPR-487) 的原子力显微镜图。将1.0 mg/mL样品在 dH2O 中稀释至 0.1 mg/mL 置于新鲜切割的云母上,清洗、干燥并以轻敲模式进行原子力显微镜分析。左图为 2.5 x 2.5 µm x-y,z 范围为 10 nm。 |
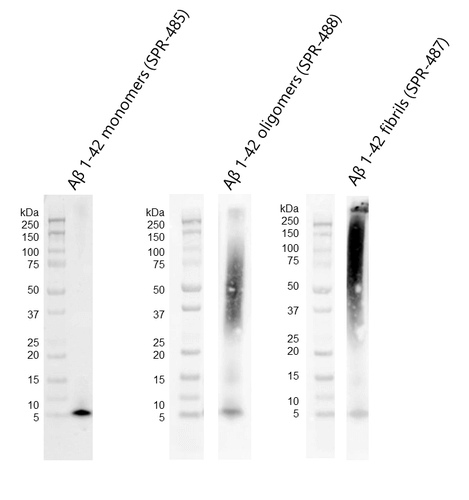 |
从左至右分别是Aβ单体 (SPR-485),寡聚体 (SPR-488) 和原纤维 (SPR-487) 的WB,抗体是抗Aβ6E10抗体。三种Aβ蛋白 (160 pmol) 在 4-12% Bis-Tris SDS-PAGE 上跑胶后,在 0.02% v/v Tween-20 存在下转移到硝酸纤维素上,并用 1:1000 小鼠 6E10 一抗做WB。在 TEM/AFM 下观察到的寡聚体显示出明显的二聚体/三聚体条带以及来自 ~37-75 kDa 的信号(中)。在 TEM/AFM 下观察到的原纤维显示出大于 100 kDa 的信号,并且在浓缩胶(右)中有明显的信号。 |
|
Aβ 1-42 寡聚体 (SPR-488) 和原纤维 (SPR-487) 对原代大鼠皮层神经元显示出剂量依赖性毒性,但单体 (SPR-485) 没有毒性。大鼠原代皮层神经元用不同浓度的 (A) 单体、(B) 寡聚体或 (C) 原纤维处理 14 天后的存活率,由 MAP2 阳性神经元量化并表示为对照的百分比(空白对照设为100%)。原纤维和相应的载体对照先在 Bioruptor 超声破碎仪中进行超声处理。测试条件在与未处理的对照和载体对照相同的板中运行,由不含Aβ 1-42 蛋白的缓冲液组成。数据表示为平均值 +/- s.e.m. (n = 6)。使用单向方差分析和 Dunnett 检验对数据进行全局分析; ** p<0.01 统计数据相比于对照; ## p<0.01, #### p<0.0001 统计数据相比于载体对照。 § 代表未经处理的对照条件。 |
产品概述
产品名称:β淀粉样蛋白
产品描述:β淀粉样蛋白 1-42 寡聚体
应用范围:WB, In vivo Assay, In vitro Assay
浓度:各批次不同,请详见说明书
标记物:无标签
性质:合成的 (TFA 制备)
来源物种:人
表达系统:N/A
氨基酸序列:DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA
纯度:>95%
蛋白长度:42 个氨基酸
产品特性
储存缓冲液:Phosphate buffer (PB) pH 7.4 and 20 mM NaCl
储存温度:-80ºC
运输温度:干冰. 运输: 该产品会与其他同订单产品分开发货.
纯化方式:N/A
Protein Size:4.5 kDa
引用该产品:Human Synthetic Amyloid Beta Oligomers (StressMarq Biosciences Inc., Victoria BC CANADA, Catalog # SPR-488)
分析证书:该蛋白已经通过质谱仪和HPLC检测证明纯度大于95%.
生物学特性
别名:Abeta Oligomers, Abeta peptide, Amyloid beta peptide oligomers, Beta amyloid peptide oligomers, amyloid beta precursor protein peptide oligomers, APP
研究领域:淀粉样蛋白, 神经生物学, 神经衰退疾病, 阿尔茨海默病
细胞定位:细胞膜
GeneID:351
Swiss Prot:P05067
科研背景:
Our Amyloid Beta 1-42 (Aβ42) Oligomers are generated from Amyloid Beta Peptide 1-42 pre-treated with 1,1,1,3,3,3-Hexafluoro-2-propanol (HFIP) as previously published (1,2). Our Aβ42 oligomers present as globular oligomers when observed under TEM and AFM, and have a unique dimer/trimer and oligomer signal on a Western Blot with an anti-amyloid beta antibody. Our Aβ42 oligomers were also demonstrated to be toxic to primary rat cortical neurons in a dose-dependent manner. In the brain, amyloid beta peptide (Aβ) is generated by protease cleavage of amyloid precursor protein (APP), which aggregates into oligomers, protofibrils, fibrils and ultimately plaques in neurodegenerative diseases. The accumulation of Aβ plaques in the brain is considered a hallmark of Alzheimer’s disease (AD), and most of the drugs tested for AD in the past 20 years have targeted amyloid beta accumulation (3). Soluble Aβ oligomers isolated from the brains of AD patients or those generated in vitro potently impaired synapse structure and function (4). Aβ oligomers generated in vitro were toxic to PC12 cells (5) and SH-SY5Y cells (6). Aβ was demonstrated to interact with tauopathies to affect neurodegeneration in AD patients (7) and accumulations of Aβ were shown to be associated with lower survival rates in Parkinson’s disease patients with dementia (8).
参考资料:
1. Stine et al. 2003. JBC. 278(13):11612-22. doi: 10.1074/jbc.M210207200
2. Ahmed et al. 2010. Nature Structural & Molecular Biology. 17(5):561-7. doi: 10.1038/nsmb.1799
3. Panza et al. 2019. Nat Rev Neurol. 15:73-88 https://doi.org/10.1038/s41582-018-0116-6
4. Shankar et al. 2008. Nat Med. 14(8):837-842. doi: 10.1038/nm1782
5. Chromy et al. 2003. Biochemistry. 42:12749-12760. doi: 10.1021/bi030029q
6. Kayed et al. 2003. Science. 300(5618): 486-489. doi: 10.1126/science.1079469
7. Want et al. 2016. JAMA Neurol. 73(9):1070-7. doi: 10.1001/jamaneurol.2016.2078
8.,Kotzbauer et al. 2012. Arch Neurol. 69(10): 1326-1331. doi: 10.1001/archneurol.2012.1608
更多详细信息,请联系Stressmarq国内代理商-上海金畔生物