EpiCypher参与项目——SMARCAL1介导的肿瘤免疫逃避

资深作者Alberto Ciccia博士(左)和第一作者Giuseppe Leuzzi博士。
在新的博客系列中,我们将对话最近发表染色质研究工作的首席科学家们,了解他们的幕后工作。在EpiCypher,我们很感兴趣染色质技术是如何整合到不同领域的,如免疫学、细胞和基因治疗、发育生物学、代谢等。他们研究的主要结论是什么呢?相关论文对表观遗传学领域有何影响呢?
在本博客中,我们采访了来自哥伦比亚大学欧文医学中心遗传与发育系的Giuseppe Leuzzi博士和Alberto Ciccia副教授,他们最近在Cell上发表了题为 “SMARCAL1 is a dual regulator of innate immune signaling and PD-L1 expression that promotes tumor immune evasion”的文章。值得注意的是,这是一项高度合作的研究,来自世界各地很多个实验室都做出了贡献——包括EpiCypher。
Ciccia实验室研究了DNA损伤反应(DDR)在基因组完整性和癌症发展中的作用。在这项研究中,论文的第一作者Giuseppe Leuzzi使用CRISPR-Cas9开发了一种新的基因筛选方法,以评估DDR因子和染色质调节因子对先天免疫信号传导和PD-L1免疫检查点表达的影响。
利用这种方法,Leuzzi及其同事确定SMARCAL1是一种新的肿瘤免疫逃避调节因子,并且有希望成为更有效的免疫肿瘤学治疗靶点。
背景:免疫检查点阻断治疗与肿瘤耐药性
人体免疫系统旨在检测和破坏异常或感染的细胞,包括快速增殖的肿瘤细胞。许多细胞类型都参与这一过程。在本博客中,我们将重点关注靶向和杀死癌细胞的CD8+ 细胞毒性T细胞。
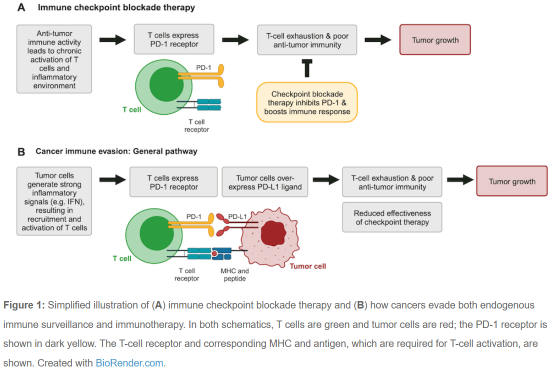
在许多癌症患者中,免疫系统被长期激活,导致CD8+ T细胞耗竭。耗竭的T细胞上调多种受体,如PD-1和CTLA-4受体,这些受体限制T细胞增殖、刺激和细胞毒性活性(图1A)。这些信号通路降低了CD8+ T细胞对抗癌症的效力,并被称为免疫检查点1-3。
靶向免疫检查点调节因子的药物代表了癌症免疫治疗的重大突破1。这些治疗方法,如PD-1抑制剂Keytruda(帕博利珠单抗),可阻断免疫检查点,并有助于恢复抗肿瘤免疫活性(图1A)。不幸的是,癌症经常会找到检查点通路或逃避免疫治疗(图1B)。了解肿瘤细胞如何调节这些信号对于开发改进的免疫疗法和生物标志物至关重要2。
DNA损伤反应是如何影响免疫检查点治疗的呢?
基因组不稳定性在癌症发生、进展和治疗反应过程中发挥关键作用。最近的研究表明,化疗和放疗诱导的DNA损伤和DNA修复抑制会提高癌细胞中干扰素(IFN)的表达。这些先天免疫信号可以通过将T细胞募集到肿瘤微环境中来放大抗肿瘤免疫反应,最终导致肿瘤的排斥反应。因此,开发肿瘤内生性IFN治疗方法可能是癌症治疗的有效策略。
然而,延长的IFN信号传导会产生慢性炎症环境,从而导致T细胞耗竭和免疫抑制1-3。此外,IFN信号传导也可导致肿瘤中PD-L1过表达,从而使肿瘤细胞逃避免疫反应和检查点治疗(图1B)。
与作者问答
Leuzzi等人探索了调节肿瘤细胞中PD-L1和炎性细胞因子表达的新机制。如何利用IFN信号增强免疫治疗呢?他们最初的CRISPR筛选结果表明,SMARCAL1 DNA易位酶蛋白在这两个通路中均发挥重要作用。他们结合转基因细胞系、小鼠模型、生化和表观基因组学测定以及 TCGA 数据来研究SMARCAL1的功能。
在下面的对话中,Leuzzi和Ciccia在该领域的背景下讨论了他们的工作。为简洁明了,我们对内容进行了编辑。
Q:可以从您的研究文章中获得什么启示呢?
A:我们发现SMARCAL1是癌症免疫逃避和免疫治疗抵抗的主要调节因子。具体而言,SMARCAL1以肿瘤固有的方式发挥作用,并允许肿瘤细胞逃避内源性免疫系统和阻断免疫检查点的治疗。
Q:这是您要研究的内容吗?
A:该研究旨在发现新的癌症药物靶点,这些靶点可以增强人体的自然防御系统,同时还可以对抗免疫逃避机制,包括肿瘤细胞配体PD-L1的过度表达。人们认为,来自癌细胞先天免疫信号(如IFN)的上调伴随免疫抑制通路的下调,可恢复对免疫检查点阻断治疗的敏感性。
Q:您认为最令人惊讶的结果是什么呢?为什么?
A:我们最震惊的是SMARCAL1缺陷的影响,它诱导了癌症自主的IFN免疫信号传导,同时下调了PD-L1水平。该结果非常出乎意料,因为传统上认为IFN信号通路上调PD-L1是免疫检查点反应的一部分。这一观察结果违背了既定的预期,揭示了由SMARCAL1缺陷介导的不可预见的转折。
Q:这项工作是如何推动该领域发展的呢?
A:这项工作通过揭示之前未被识别的在肿瘤免疫逃避中起作用的SMARCAL1推动了这一领域的发展。值得注意的是,SMARCAL1使用独特的双重机制来调节IFN信号和PD-L1水平。首先,SMARCAL1通过限制内源性DNA损伤来抑制先天免疫信号传导。其次,SMARCAL1与JUN协同诱导PD-L1表达,使细胞逃避免疫系统的监视。这些发现为破坏逃避机制的靶向干预开辟了新途径,有可能提高癌症免疫治疗的有效性。
Q:CUT&RUN和EpiDyne试验为此提供了哪些重要的见解呢?
A:EpiCypher团队的专业知识,加上他们CUT&RUN chromatin mapping和EpiDyne™ nucleosome remodeling技术的使用,在揭示连接SMARCAL1和PD-L1表达的分子机制方面发挥了至关重要的作用。CUT&RUN实现了SMARCAL1结合位点的精确定位,揭示了其与JUN在转录活性染色质区域的合作。EpiDyne分析有助于评估SMARCAL1染色质的重塑能力。总之,这些技术为SMARCAL1如何影响染色质图谱和调节PD-L1免疫检查点基因提供了综合分子表征。
总结和结论
这篇激动人心的论文将DNA损伤反应和染色质调节与肿瘤免疫逃避和免疫治疗耐药性联系起来,从而为肿瘤免疫治疗的发展迎来了新的机遇。非常感谢Leuzzi 和Ciccia博士花时间与我们分享他们的工作,强烈推荐阅读他们的整篇论文(https://linkinghub.elsevier.com/retrieve/pii/S0092867424000102)。
参考文献
1. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer 12, 252-64 (2012). https://doi.org/10.1038/nrc3239.
2. Fares CM et al. Mechanisms of Resistance to Immune Checkpoint Blockade: Why Does Checkpoint Inhibitor Immunotherapy Not Work for All Patients? Am Soc Clin Oncol Educ Book 39, 147-64 (2019). https://doi.org/10.1200/EDBK_240837.
3. Klapp V et al. The DNA Damage Response and Inflammation in Cancer. Cancer Discov 13, 1521-45 (2023). https://doi.org/10.1158/2159-8290.CD-22-1220
4. Leuzzi G et al. SMARCAL1 is a dual regulator of innate immune signaling and PD-L1 expression that promotes tumor immune evasion. Cell (2024). https://doi.org/10.1016/j.cell.2024.01.008
EpiCypher的注册商标和知识产权可见链接:https://www.epicypher.com/intellectual-property/。
本文中的所有其他商标和商品均为其各自公司所有。
本文翻译自链接https://www.epicypher.com/resources/blog/nuc-narratives-smarcal1,如与原文有出入的地方,请以英文原文为准。
未经EpiCypher公司事先书面同意,本文件不得部分或全部复制。
关于EpiCypher公司:
EpiCypher是一家成立于2012年的表观遗传学公司。从专有组蛋白肽阵列平台EpiGold™开始,EpiCypher开发了一系列同类产品。同时,EpiCypher是重组核小体制造和开发的全球领导者。利用其独有技术,不断增加产品库中高纯度修饰重组核小体(dNucs™)产品。dNuc™多样性的产品为破译组蛋白编码和加速药物开发提供了强大的工具。
EpiCypher还将dNuc™技术广泛的应用于多种分析测定产品中,包括:SNAP-ChIP®Spike-in Controls(用于抗体分析和ChIP定量), EpiDyne®底物(用于染色质重塑和抑制剂筛选及开发),dCyher™测定(用于探究表观遗传蛋白质-组蛋白PTM结合相互作用)。最近,EpiCypher还推出了针对ChIC、CUT&RUN和CUT&Tag的高灵敏度表观基因组图谱CUTANA™分析。
如需了解更多详细信息或相关产品,请联系EpiCypher中国代理商-上海金畔生物
