炎症小体的调节
炎症小体通过释放炎性细胞因子和警报素导致细胞焦亡,来构成快速而强效的免疫防御。这些异动必须小心调控在一定的损伤范围内,同时塑造出随后的适应性免疫反应。因此,严格调节炎症小体除了保证充份的免疫保护外,也防止不必要的激活,限制附带组织的损伤。 炎症小体应答的所有步骤中都存在多层防护措施。
调节炎症小体的复杂性很大程度上建基于所涉及分子的多样性。实际上,炎症小体需要依赖传感器(例如NLRP3、NLRC4和NAIP)、接头蛋白和支架蛋白(例如ASC和NEK7)、炎性caspase(CASP-1和CASP-11/4/5)、成孔蛋白(例如GSDMD)、炎性细胞因子(IL-1β和IL-18)和警报素蛋白(例如IL-1α)的不同参与者。这些分子都在基因组和蛋白水平上受到不同程度的控制。
启动步骤可转录上调可转录上调处于较低本底水平的炎症小体成分和效应蛋白 [4, 67]。PRR激动剂是触发转录因子(主要是NF-κB 和干扰素调节因子(IRFs))活化的主要启动剂。例如,NLRP3和Pyrin的表达是由NF-κB介导的,而鼠源NAIP的表达依赖于IRF8。现时对于ASC接头蛋白和CASP-1的转录调控知之甚少,尚有待进一步的研究了解。非经典炎症小体CASP-11/4/5会根据细胞类型而
有差异地上调。成孔蛋白GSDMD以及细胞穿透蛋白GBPs和IRGB10的表达分别依赖于IRF1/2和IRF1。IL-1α警报素、pro-IL-1β和pro-IL-18细胞因子的诱导表达则似乎依赖于不同的转录因子,详细机理仍在研究中。不过已知的是,转录上调对于pro-IL-1β是必须的。
炎症小体还受翻译后修饰(PTMs)的调控,这些修饰包括磷酸化,泛素化,去泛素化和蛋白水解切割 [44, 81]。 PTM由不同的刺激(例如PRR激动剂或炎症小体传感器的诱导剂)触发,并可以定位到同一炎症小体的特定残基上,从而导致不同的结果。虽然NLRP3的调控已有广泛的研究,但其他受PTM调控的炎症小体分子,包括ASC,CASP-1和pro-IL-1β仍有待探讨 [44, 81]。值得注意的是,由PTM驱动的调节功能可确保炎症小体平台组装所需的构象变化。此外,CASP-1和CASP-11/4/5的自我激活、pro-IL-1β/IL-18转化为其生物活性形式以及GSDMD释放N-末端结构域的过程都需要经蛋白水解进行切割。PTMs的其他调节功能包括终止应答,例如诱导已组装的炎症小体向自噬小体的递送 [45, 84, 85]。由于PTMs控制着炎症小体反应的多个步骤,并且依赖于酶的活性,它们因此成为具吸引力药物靶点,调节参与炎症性疾病的炎症小体。
启动(Priming)试剂
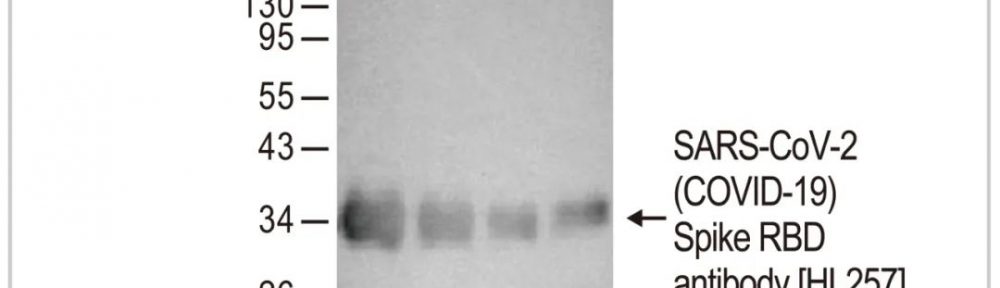
LPS
脂多糖(LPS)为革兰氏阴性细菌(如大肠杆菌)外膜的主要成分,是一种强效的先天免疫系统诱导剂。它在细胞表面被TLR4识别,使TLR4与CD14和MD-2形成复合物,触发信号级联反应,导致NF-κB和IRF3转录因子的激活 [83],以及促炎性细胞因子和I型干扰素的产生。要避免巨噬細胞经佛波酯
(PMA)诱导分化后出现高背景的情况,可以在PMA刺激后使用LPS预处理约1周。
Poly(I:C)
聚肌胞苷酸(Polyinosine-polycytidylic acid)简称Poly(I:C),是双链RNA(dsRNA)的合成类似物,也是与病毒感染相关的PAMP。Poly(I:C)除了激活TLR3,也也可以激活RIG-I/MDA5和PKR,从而通过NF-κB和IRF途径诱导炎性信号 [84, 85]。
Pam3CSK4
Pam3CSK4(或Pam3CysSerLys4)是细菌细胞壁脂肽酰化氨基末端的合成模拟物。它是一种强效的TLR2激活剂,通过与TLR1的协同作用,诱导NF-κB的活化 [86]。我们建议使用Pam3CSK4启动RAW264.7衍生的巨噬细胞,以避免出现高背景的情况。
如果要诱导人源CASP-4/5和鼠源CASP-11非经典炎症小体的表达,我们高度推荐使用IFN-γ来预处理细胞(产品可咨询上海金畔生物)。
相关产品:
| 产品名称 | 产品货号 | 规格 |
| LPS-EK Ultrapure (E.coli K12) | tlrl-peklps | 1 mg |
| Pam3CSK4 | tlrl-pms | 1 mg |
| Poly(I:C) HMW | tlrl-pic | 10 mg |
详情请咨询 Invivogen代理商-上海金畔生物