我的样本可以用于CUT&RUN吗? 四大因素需考量
我的样本可以用于CUT&RUN吗? 四大因素需考量
CUT&RUN技术使用完整的细胞或细胞核来绘制组蛋白翻译后修饰(PTMs)和染色质相关蛋白(如转录因子)的全基因组富集图谱。在EpiCypher,客户经常会问,“我的细胞样本适用于CUT&RUN技术吗? ”尽管大家希望所有细胞都可以表现出理想的适用性,但事实并非如此。
在这里,我们将讨论EpiCypher在评估CUT&RUN实验中细胞使用的主要标准。通常情况下,不理想的样本质量=不理想的CUT&RUN数据。

1.细胞数量
为了获得可靠精准的实验数据,EpiCypher建议在CUT&RUN实验中每个反应使用500,000个细胞。在实验过程中,我们分两次对细胞进行计数:第一次是在最初的细胞采集时,第二次是将细胞固定在磁珠上之前。第二次计数的目的是确保在使用CUT&RUN缓冲液洗涤过程中没有大量细胞样本的丢失或细胞裂解的发生。有关具体指导信息,请点击技术支持中心了解详情。
CUTANA™ CUT&RUN成功将选定的目标细胞数减少到5000个。需要注意的是,使用较低的细胞数可能会降低CUT&RUN产量,所以需要据此对文库制备和测序进行调整。如果出现这些情况,请点击CUT&RUN Library Prep Kit手册以获得实用建议。
2.细胞活力
EpiCypher在细胞收获时就会测定细胞活力或“活细胞”的百分比。初始细胞的活力对于CUT&RUN实验的成功至关重要。低活力可能导致分析背景增加、产量降低以及在实验过程中细胞/磁珠出现聚集的问题。
值得注意的是,细胞的最佳活力高度依赖于样本类型。例如,用于CUT&RUN实验的K562细胞我们要求在培养收获时有>90%的活力。然而,对于其他某些样品类型或实验条件,细胞的最佳活力可能较低。
关于细胞活力和细胞计数方法的小提示
EpiCypher建议使用简单的台盼蓝染色方法来计数细胞并确定初始细胞活力。因为台盼蓝染料对细胞有毒,所以在添加染料后一定要立即计数。
有些细胞对台盼蓝高度敏感。如果细胞在台盼蓝染色时显示出较低的活力,但在培养过程中具有预期的形态、最小的裂解度且能正常生长,那么这些细胞可能适用于CUT&RUN技术。对此,我们建议使用浓度更低的台盼蓝染料或尝试其他细胞计数方法(如碘化丙啶)来确认细胞活力。

3.细胞形态和完整性
CUT&RUN技术需要形态正常的完整细胞。形态是指细胞形状,与组织来源和/或细胞在培养基中的生长方式有关。悬浮细胞,如K562细胞,通常来源于血细胞和/或肿瘤细胞,具有圆形和对称的形态。由于贴壁细胞可以来源于上皮、内皮、神经元或成纤维细胞组织,因此表现出不同的形态和扩增特征。例如,上皮细胞往往具有均匀的细胞形状,可以在细胞培养板上成片生长,而成纤维细胞表现出不对称、细长的形态,可用于研究细胞迁移。
使用裂解或质量差的细胞也会导致数据质量低。为了确保有效的样品制备,EpiCypher在初始细胞采集和磁珠结合之前均会检查细胞形态和细胞膜的完整性。第二次检查很重要,因为一些样品类型(例如FACS分离的细胞或来自组织的细胞)可能对CUT&RUN洗涤缓冲液中的裂解成分更敏感。在这些情况下,我们建议在进行CUT&RUN实验时分离细胞核(Figure 1)。
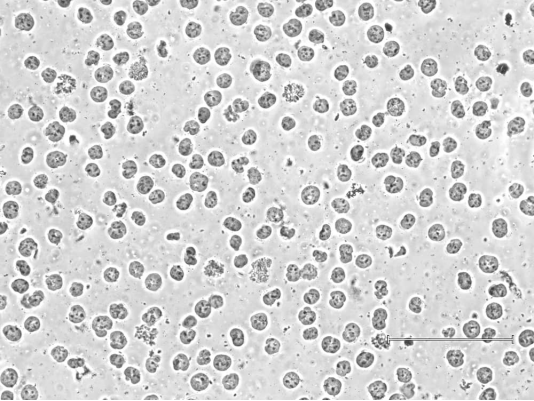
Figure 1: Successful isolated K562 cell nuclei. Image by Liz Albertorio-Sáez M.Sc.
4.细胞来源注意事项:细胞系、原代细胞、组织和干细胞
细胞的形态、活力和数量会直接受到细胞来源的影响。CUT&RUN实验使用的细胞可以来自组织、细胞系、培养的原代细胞或通过其他方式纯化的细胞(例如FACS)。下面我们将讨论这些细胞样本的优势和面临的挑战。
√ 永生化细胞系
示例:HEK293、HeLa、K562、NIH/3T3、MCF-7(Figure 2)、H1299(Figure 3)、A549和THP-1细胞系。
优点:一般来说,细胞系是CUT&RUN技术中最容易优化的input。细胞系可以提供:
● 大量具有高活力的细胞——CUT&RUN实验成功的关键。
● 精准且可高度重复的CUT&RUN实验结果——源于细胞系的同质性。
● 用于药物筛选、基因过表达/抑制等的强大系统——不会破坏样本质量。
缺点:细胞系的使用有很多注意事项,概述如下。而根据实验目的,细胞系可能是最佳的来源选择。
● 一般来说,细胞系不能代表体内条件。它们通常来源于肿瘤细胞或其他病变细胞群,与原代细胞相比,它们的功能可能不同。
● 细胞系容易发生基因组改变,包括染色体异常、重复和/或遗传漂移。
● 被其他细胞系污染很常见。错误细胞系的鉴定结果可能会妨碍测定的重现性,并导致错误的生物学结论。
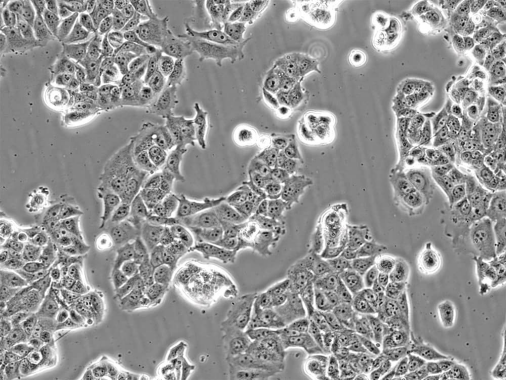
Figure 2: MCF-7 breast cancer cells in culture. Image by Liz Albertorio-Sáez M.Sc.
√ 原代细胞
示例:来源于活体组织样品,固体(如肠、肺、肝、皮肤)或液体(如血液),经过或未经过细胞培养的均可。
优点:原代细胞经常用于CUT&RUN,因为研究者使用它们可以:
● 探究在天然异质的细胞环境中染色质的功能和生物学机制。
● 研究通过FACS或其他技术分离的稀有细胞的功能状态。
● 确定细胞对体内刺激或药物治疗的反应。
● 表征患者样本(例如肿瘤VS.健康细胞)。
缺点:原代细胞的缺点取决于研究的组织和细胞类型。在研究原代细胞时,可能面临的挑战有:
● 分离足够数量的细胞——在分离过程中细胞的敏感性(如FACS)或在组织中的低丰度。
● 获得具有高活力的细胞——原代细胞通常需要小心处理以防发生裂解。
● 扩大培养——原代细胞在培养基中的生长能力通常仅限于几个阶段,需要仔细规划并优化实验时间表。
● 获得一致的实验结果——特别是来源于含有许多不同细胞类型的大块组织。
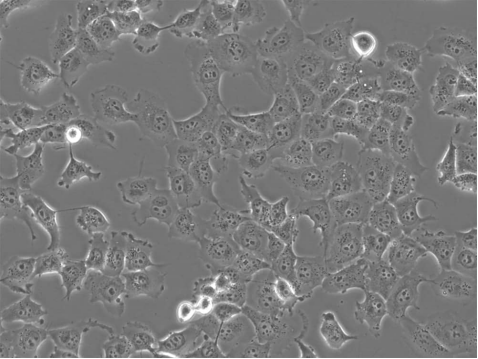
Figure 3: H1299 non-small cell lung carcinoma cells in culture. Image by Liz Albertorio-Sáez M.Sc.
√ 干细胞
示例:诱导多能干细胞(iPSCs)、间充质干细胞和胚胎干细胞。
优点:生长和培养多能干细胞群和成体干细胞群的功能使以下研究成为可能:
● 研究细胞发育、分化和疾病发展过程中的表观遗传学变化。
● 生成用于功能分析和治疗开发的稀有细胞类型。
● 开发用于个性化医疗应用的患者特异性细胞群。
● 使用二维细胞和/或类器官培养研究细胞的生长和分化。
缺点:尽管干细胞在细胞和基因治疗研究以及发育生物学方面有前景,但干细胞的研究在许多方面都面临挑战:
● 干细胞培养需要丰富的经验,即便如此,扩增某些干细胞群也很困难。
● 培养干细胞需要多种质控措施和精确的监测,成本高且耗时。
● 不同研究人员之间的分化方案可能会有所不同,从而引入意想不到的偏差和变化。
EpiCypher的注册商标和知识产权可见链接:https://www.epicypher.com/intellectual-property/。
本文中的所有其他商标和商品均为其各自公司所有。
本文翻译自链接https://www.epicypher.com/resources/blog/will-my-sample-work-in-cut-and-run/,如与原文有出入的地方,请以英文原文为准。
未经EpiCypher公司事先书面同意,本文件不得部分或全部复制。
关于EpiCypher公司:
EpiCypher是一家成立于2012年的表观遗传学公司。从专有组蛋白肽阵列平台EpiGold™开始,EpiCypher开发了一系列同类产品。同时,EpiCypher是重组核小体制造和开发的全球领导者。利用其独有技术,不断增加产品库中高纯度修饰重组核小体(dNucs™)产品。dNuc™多样性的产品为破译组蛋白编码和加速药物开发提供了强大的工具。
EpiCypher还将dNuc™技术广泛的应用于多种分析测定产品中,包括:SNAP-ChIP®Spike-in Controls(用于抗体分析和ChIP定量), EpiDyne®底物(用于染色质重塑和抑制剂筛选及开发),dCyher™测定(用于探究表观遗传蛋白质-组蛋白PTM结合相互作用)。最近,EpiCypher还推出了针对ChIC、CUT&RUN和CUT&Tag的高灵敏度表观基因组图谱CUTANA™分析。
如需了解更多详细信息或相关产品,请联系EpiCypher中国代理商-上海金畔生物
