磷酸化蛋白—Phos-tag™ 丙烯酰胺蛋白研究-Wako富士胶片和光
| 供货周期 | 一个月以上 | 规格 | 0.3mL/2mg/10mg |
|---|---|---|---|
| 货号 | 304-93526/300-93523/304-93521 | 应用领域 | 化工,生物产业 |
磷酸化蛋白—Phos-tg™ 丙烯酰胺
Phos-tag™ SDS-PAGE操作简单,只需在常规SDS-PAGE胶中加入Phos-tag™ Acrylamide 和二价锰离子或者锌离子即可进行实验。在电泳过程中,磷酸化蛋白的磷酸基团与Phos-tag™中的二价金属离子相结合,降低其迁移速度,从而可区分磷酸化与非磷酸化蛋白。
 SDS-PAGE分离不同磷酸化水平的蛋白!
SDS-PAGE分离不同磷酸化水平的蛋白!
在不使用放射性同位素的情况下,利用Phos-tag™ SDS-PAGE即可分离不同条带中的磷酸化和非磷酸化蛋白。分离后的凝胶可用于蛋白质印迹和质谱分析等后续实验。
Phos-tag™ SDS-PAGE操作简单,只需在常规SDS-PAGE胶中加入Phos-tag™ Acrylamide 和二价锰离子或者锌离子即可进行实验。在电泳过程中,磷酸化蛋白的磷酸基团与Phos-tag™中的二价金属离子相结合,降低其迁移速度,从而可区分磷酸化与非磷酸化蛋白。
◆原理
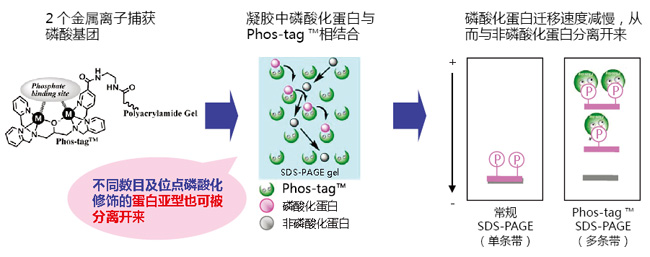
◆优点、特色
● 采用Phos-tag™ SDS-PAGE可轻松分离磷酸化蛋白
无任何放射性元素及化学标记!
● 可检测不同磷酸化水平的磷酸化蛋白
无需任何磷酸化抗体!
● 适用于内源性蛋白的磷酸化分析!
◆案例、应用
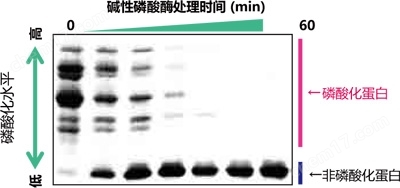

【使用Phos-tag™ SDS-PAGE的磷酸化/非磷酸化蛋白比较】
我推荐使用Phos-tag ™ ——东京大学研究院医学研究科 小川觉之
Phos-tag ™ 是专为研究磷酸化蛋白而新开发出来的试剂。此产品使用方便,不但可用于体外实验,还能定量分析体内蛋白的磷酸化水平。可用于常规电泳实验,无需购买特殊设备,性价比高。传统蛋白磷酸化的研究需要特异的磷酸化抗体、RI 等其它试剂,操作复杂,花费大,且放射性元素会有安全隐患,而Phos-tag ™ 的出现恰恰可以弥补这些缺点,为磷酸化蛋白研究提供新的方向。
磷酸化蛋白和非磷酸化蛋白利用Phos-tag ™ SDS-PAGE 的分离效果图
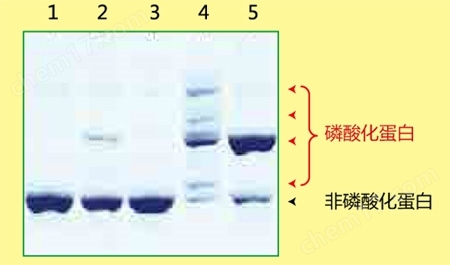
Lane 1 为非磷酸化蛋白,Lane 2-5 为磷酸化蛋白,各蛋白因磷酸化状态不同而条带迁移率也有所不同。
磷酸化/ 非磷酸化蛋白的数量比、磷酸化程度、磷酸化蛋白的丰度等都可根据条带迁移和条带浓度求得。
【资料提供】
日本东京大学研究生院医学系研究科
【二维电泳中的应用:分析hnRNP K 磷酸化异构体】
小鼠巨噬细胞J774.1 经LPS 刺激后,裂解细胞,经过免疫沉淀法分离得到hnRNP K。在二维电泳中,一维是IPG 胶,二维是Phos-tag ™ SDS-PAGE,可分离hnRNP K 的异构体。利用质谱仪,可以确认不同的点代表不同的亚型或修饰蛋白。
二维电泳

同一个等电点的位置上,不同位点发生磷酸化都可以被区分开来(例: spots 6 vs. 8 and spots 4 vs. 7)
【结果提供】
横滨市立大学 生命纳米系统科学研究科 生物体超分子系统科学专业 木村弥生、平野久理化学研究所RCAI 小原收
【EGF 刺激前后MAPK 磷酸化水平的变化】
常规SDS-PAGE 和Phos-tagTM SDS-PAGE 后迚行克疫印迹实验分析EGF 刺激的A431 细胞中MAPK 磷酸化水平。
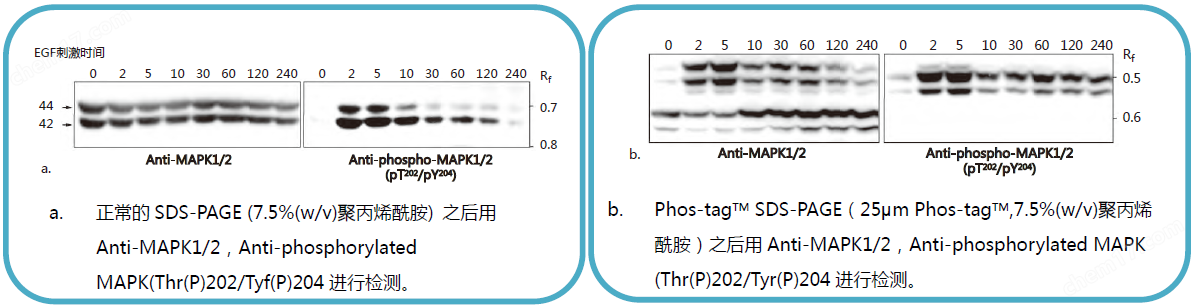
SDS-PAGE分离不同磷酸化水平的蛋白
1. Phos-tag® Acrylamide的溶解
5 mmmol/ Phos-tag® 液体 (3v/v% 甲醇):
1)10 毫克 Phos-tag® Acrylamide 里加入 0.1 毫升 甲醇
2)使用枪头搅拌混合直至*溶解。
3) 加3.2 毫升 蒸馏水, 用枪头混匀。
2-8℃避光保存。不适合零度以下保存。建议保存时间6个月。
注意:避免溶解过程出现白色悬浮颗粒。
2. α-Casein, from Bovine Milk, Dephosphorylated(038-23221),阳性对照(含有磷酸化和非磷酸化α-Casein),如何使用?
用水或者上样buffer溶解。用水溶解后,冷冻保存。电泳条件:Phos-tag® 50 umol/L,分离胶浓度 10%。
电流:30 mM,1小时。
3. 用Alkaline Phosphatase(for Biochemistry)(018-10693)进行磷酸化蛋白的去磷酸化反应体系。
37℃,过夜。# 10 mg/mL phosphorylated protein 50 微升
# 0.50 M Tris/HCl buffer (pH 9.0) containing 0.10 M MgCl2 10 微升
# Sterilized water 39 微升
# Alkaline phosphatase(018-10693). 0.3 unit / 1 μL有一点需要注意:ALP活性化使用Mg离子,相同的非磷酸化蛋白质用ALP处理的样品的条带和没有用ALP处理的样品的条带的位置不同。
4. Phos-tag® SDS-PAGE实验没有成功分离磷酸化蛋白:
1)使用α-Casein, from Bovine Milk, Dephosphorylated(038-23221)作为阳性对照,确认实验条件和试剂均没有问题。
2)可使用Phos-tag® Biotin检测样品中是否有磷酸化蛋白。确认有磷酸化蛋白后,再通过Phos-tag® SDS-PAGE进行分离鉴定。
3)经质谱鉴定有表达磷酸化蛋白,建议增大样品的含量,可使用Phos-tag® Agarose进行磷酸化蛋白的富集。磷酸化蛋白含量过低,会影响其分离效果。
4)文献报道有表达磷酸化蛋白,或者同源蛋白有表达磷酸化蛋白的,建议用Phos-tag® Biotin先确认 样品中是否有磷酸化蛋白。
5)建议样品的pH值在7左右。酸性或者碱性条件下,二价锰离子 -Phos-tag® 与磷酸化基团的特异性结合较差。
6)避免样品中含有高浓度的还原剂,变性剂,表面活性剂等。β-巯基乙醇浓度不高于0.2 M(或者5%)。
7)进行Phos-tag® SDS-PAGE的合适样品是纯化的蛋白。如果是细胞裂解液,体外激酶反应液,组织均浆液等,需要摸索合适的分离胶,Phos-tag® Acylamide的浓度。建议Phos-tag® Acrylamide浓度从50 μM开始摸索。
5. Phos-tag® SDS-PAGE凝胶用于Western Blotting实验的优化建议:
1)可以检测的样品包括体外激酶反应体系,细胞裂解液,组织均浆液。
2) 每孔样品的上样量是10~30 微克(请根据蛋白表达量进行调整)
3) 制备样品中含有的还原剂、变性剂、螯合剂、钒酸等会使电泳条带发生弯曲或者拖尾。通过TCA沉淀或渗析法降低杂质含量。
4)建议样品的pH值在7左右。如果加入上样缓冲液后溶液显黄色或者橙色,加入Tris缓冲液调整pH值为7。
5)目的蛋白分子量大于60 kDa,分离胶的丙烯酰胺浓度为6%;目的蛋白分子量小于60 kDa,分离胶的丙烯酰胺浓度为8%。
6)如果样品中含有大量蛋白,比如细胞裂解液,组织均浆液,Phos-tag®乙酰胺浓度为5~25 uM。若目的蛋白浓度低,建议Phos-tag® 乙酰胺浓度为100 uM。
7)Phos-tag® SDS-PAGE凝胶用于Western Blotting实验,湿法转膜建议:10 mM EDTA的转移缓冲液处理凝胶10 分钟,不含有EDTA的转移缓冲液处理凝胶10 分钟。重复3次。强烈建议湿法转膜
8)Phos-tag® SDS PAGE半干法转膜建议:
i.电泳后用含有EDTA的转移缓冲液处理凝胶,EDTA的浓度为 100 mM。100 mM EDTA的转移缓冲液处理凝胶10 分钟,不含有EDTA的转移缓冲液处理凝胶10 分钟。重复3次。
ii.转膜的电流值提高2%~3%, 延长时间2成。
iii.转膜的缓冲液加SDS,加到大约0.05~0.2%,转膜效率会提高。
9)使用目的蛋白的非磷酸化抗体即可。比如检测各种肿瘤细胞系中Src激酶活性实验,用Src的非磷酸化抗体即可。
10)和光的WIDE-VIEW™ Prestained Protein Siza MarkerIII(230-02461)可检测作为转膜效率,但是无法判断分子量。
11)一般预染的蛋白marker在Phos-tag® SDS-PAGE中条带会弯曲,无法判断蛋白分子量。
12)不能确认磷酸化蛋白和非磷酸化蛋白的分离,请进行常规的SDS-PAGE,Western Blotting实验。比对目的蛋白的迁移率。
13)不能确认是因为蛋白发生磷酸化还是出现降解造成蛋白条带迁移,请进行常规的SDS-PAGE实验,确认不会出现条带迁移。
14)目的蛋白磷酸化与非磷酸化分离效果不佳,使用α-Casein, from Bovine Milk, Dephosphorylated(038-23221)作为阳性对照,确认实验条件和试剂均没有问题。如果确认能够分离,调整分离胶, Phos-tag® Acylamide的浓度。建议使用品质佳的氯化锰(139-00722)。
